Empfindliche Zähne. Schmerzempfindliche Zähne sind ein anhaltendes klinisches Problem, das eine große Herausforderung für das zahnärztliche Team darstellt und die Lebensqualität der Patienten drastisch beeinträchtigt. Ein besseres Verständnis der Schmerzempfindlichkeitsbelastung und der damit verbundenen Faktoren kann bei der Ressourcenplanung zur Reduzierung und Verhinderung jeglicher durch diese Erkrankung verursachten Beschwerden hilfreich sein und den Behandlungsentscheidungsprozess in der Praxis unterstützen [1].
Schmerzempfindlichkeit der Zähne ist ein Symptom, und hat Auswirkungen auf die Mundgesundheit und Lebensqualität des Patienten. Die Schmerzempfindlichkeit ist häufig durch eine Dentinhypersensibilität bedingt. Dentinhypersensibilität ist definiert als ein kurzer, stechender Schmerz, der normalerweise als Reaktion auf thermische, verdunstungsbezogene, taktile, osmotische oder chemische Reize entsteht und keiner anderen Zahnerkrankung zugeschrieben werden kann. Zervikale Dentinhypersensibilität, empfindliche Zahnhälse, hypersensible Zahnhälse oder sensible Wurzeloberfläche sind Bezeichnungen, die alle für dasselbe Beschwerdebild verwendet werden. Die Entwicklung von Dentinhypersensibilität wurde auf eine Schwelle offener Dentintubuli zurückgeführt, die auf den Verlust der Zement-, Schmier- und/oder Häutchenschicht der zervikalen Wurzeloberflächen zurückzuführen ist. Dentinhypersensibili- tät wurde in der modernen Literatur als eine schnell induzierte Schmerzreaktion auf einen Reiz durch Luft, Kälte, Berührung, elektrische Impulse, Säureeinwirkung oder eine Kombination dieser Reize am Dentin im zervikalen Bereich des Zahns beschrieben [2].
Ätiologie
Den im Mund sichtbaren Teil des Zahns bezeichnet man als Zahnkrone und den im Kiefer steckenden, nicht sichtbaren Teil als Zahnwurzel. Der meist fließende Übergang zwischen Zahnkrone und Zahnwurzel ist der Zahnhals. Die Zahnkrone wird von Schmelz bekleidet, der aus anorganischen Komponenten (ca. 95 %; Kalzium, Phosphat, Magnesium, Natrium usw.), organischen Bestandteilen (Proteine) und Wasser besteht. Die Kalziumphosphatverbindung im Schmelz heißt Apatit und Apatitkristalle bilden sog. Prismen, die eng aneinander liegen. In den Zwischenräumen befindet sich Wasser und über diese Wasserhülle können Ionen aus der Mundhöhle abgelagert werden, wie etwa die Fluoridionen, die den Schmelz vor Demineralisation schützen. Durch die Einlagerung von Fluoridionen in den Schmelz wird der Schmelz resistenter gegen Säureangriffe. Schmelz ist die härteste Substanz des Körpers, er kann Fluoridionen aufnehmen, wird aber nach Zahndurchbruch nicht mehr neu gebildet. Seine Oberfläche ist schmerzunempfindlich. Dentin befindet sich unter dem Schmelz und besteht aus organischen (ca. 20 %; Kollagen, Nicht-Kollagen-Matrix und Wasser) und anorganischen Bestandteilen ( ca. 70 %; Kalzium, Phosphat usw.). Im Dentin sind mit Flüssigkeit gefüllte Kanälchen (Dentintubuli), die zur Pulpa führen; aus der Pulpa ragen Odontoblasten und Nervenendigungen in das Dentin. Zu den wichtigsten Eigenschaften des Dentins zählt, dass es die Hauptmasse des Zahns ausmacht, lebenslang neu gebildet werden kann, aus Hydroxylapatit besteht und schmerzempfindlich ist. Die Gingiva ist ein Teil des Parodonts, dient zur Verankerung der Zähne und bildet einen Teil der Mundhöhlenauskleidung. Sie bietet außerdem einen Schutz vor äußeren Reizen. Eine klinisch gesunde Gingiva ist blassrosa, liegt fest am Zahn an und blutet nicht bei Sondierung. Als letzte Struktur ist das Wurzelzement zu nennen. Das Wurzelzement bedeckt die gesamte Zahnwurzel. Streng genommen ist es ein Teil des Zahns, funktionell gehört es zum Zahnhalteapparat, da die Bindegewebsfasern und die Wurzelhautfasern in ihm verankert sind. Das Zement wird von der Schmelz-Zement-Grenze zum Apex hin immer dicker [3]. Verschiedene Studien haben gezeigt, dass Dentinhypersensibilität bei nichtkariösen zervikalen Läsionen durch freiliegende Dentintubuli an der Dentinoberfläche verursacht wird. Gewöhnlich wird die Freilegung des Dentins im zervikalen Bereich durch drei Faktoren verursacht: Abrasion, Erosion und Abfraktion [4], auch wenn nicht immer die Prozesse von Abrasion, Erosion und Abfraktion eine Schmerzempfindlichkeit der Zähne verursachen. Darüber hinaus neigen Personen mit einem dünnen Zahnfleischphänotyp (d. h. mit einem schmalen Band keratinisierter Schleimhaut) dazu, mehr Biofilm anzusammeln, und werden daher anfälliger für Zahnfleischrückgang und anschließende Dentinfreilegung (Fotos 1 und 2). Der Schweregrad der Schmerzempfindlichkeit hängt von den Eigenschaften des freiliegenden Dentins ab, d. h., nicht jede Freilegung des Dentins führt zu einer lokalen Überempfindlichkeit.
Das Vorhandensein einer Schmierschicht, das Ausmaß der peritubulären Dentinsklerose und das lokale Ausmaß des reparativen Dentins können die Durchgängigkeit der Dentintubuli verändern und so den Flüssigkeitsfluss und die Stimulation des Odontoblastenprozesses verringern. Das bedeutet, dass es dadurch zu einer Änderung der Stimulidurchlässigkeit kommen kann und dementsprechend weniger Sensibilitäten entstehen. Ein Großteil der aktuellen Meinungen zur Dentinhypersensibilität basiert eher auf logischen und vernünftigen Annahmen als auf wissenschaftlichen Erkenntnissen. Die aktuelle Theorie besagt, dass empfindliches Dentin auf dem reizinduzierten Flüssigkeitsfluss in den Dentintubuli und der daraus resultierenden Nozizeptoraktivierung im Grenzbereich von Pulpa und Dentin beruht. Es wird angenommen, dass intradentale myelinisierte Fasern (Aβ-und einige Aδ-Fasern) auf Reize reagieren, die die Flüssigkeit in den Dentintubuli verdrängen, was zu den charakteristische kurzen, scharfen Schmerzen einer Dentinhypersensibilität führt Diese Art der Flüssigkeitsbewegung kann durch Messung der hydraulischen Leitfähigkeit des Dentins quantifiziert werden. Daher hat Dentin mit einem hohen Leitwert einen niedrigen Widerstand und umgekehrt. Humanstudien haben gezeigt, dass die Durchgängigkeit der Dentintubuli ein wichtiges Merkmal von empfindlichem Dentin ist, mit einer signifikant positiven Korrelation zwischen der Dichte der Tubuli und den Schmerzreaktionen, die durch freiliegende zervikale Dentinoberflächen hervorgerufen werden. Über etwaige Pulpaveränderungen, die mit Sensibilitätsschmerzen einhergehen, wurde unter Forschern viel diskutiert. Der Status der Pulpa bei Dentinhypersensibilität ist nicht bekannt, obwohl die Symptome aufgrund ihrer langen Dauer darauf schließen lassen, dass es unwahrscheinlich ist, dass eine akute oder chronische Entzündung vorliegt. Die meisten Untersuchungen berichten über keinen Zusammenhang zwischen Pathologie und Symptomen. Weitere Studien an extrahierten Zähnen lieferten überzeugende Beweise für diesen Zusammenhang,
wobei empfindliche Zähne im Vergleich zu nichtempfindlichen viel mehr (achtmal) und auch breitere (zweimal) Tubuli im bukkalen Halsbereich aufwiesen. Darüber hinaus wurde nur bei empfindlichen Zähnen ein Eindringen von Farbstoff in die Pulpa beobachtet. Kürzlich wurden neue Erkenntnisse gewonnen, die eine mögliche wichtige Rolle der Odontoblasten im Schmerzmechanismus der Dentinhypersensibilitätbelegen. Die Odontoblasten sind eng mit den Nervenenden verbunden, und biologische Signale werden wahrscheinlich von den Odontoblasten an die Axone und umgekehrt weitergeleitet. Eine sensorische Innervation (Wahrnehmung von Schmerzen) findet nur in Dentintubuli mit lebensfähigen Odontoblasten statt, die ihre Säulenform beibehalten [5].

Foto 1: Beispiel dünne Phänotyp
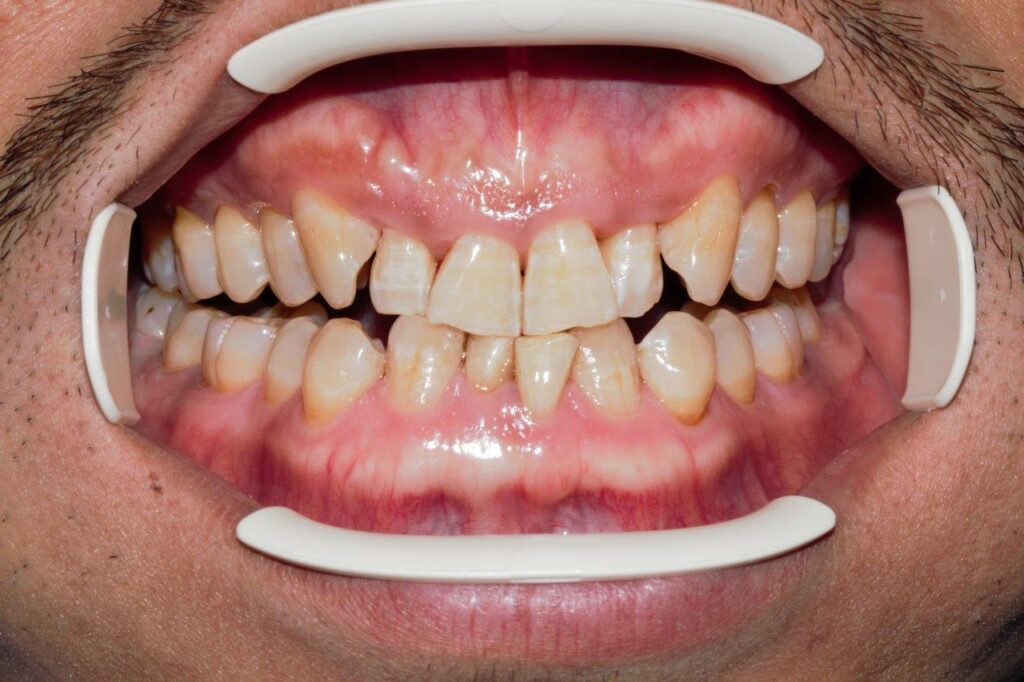
Foto 2: Beispiel dicke Phänotyp
Behandlung
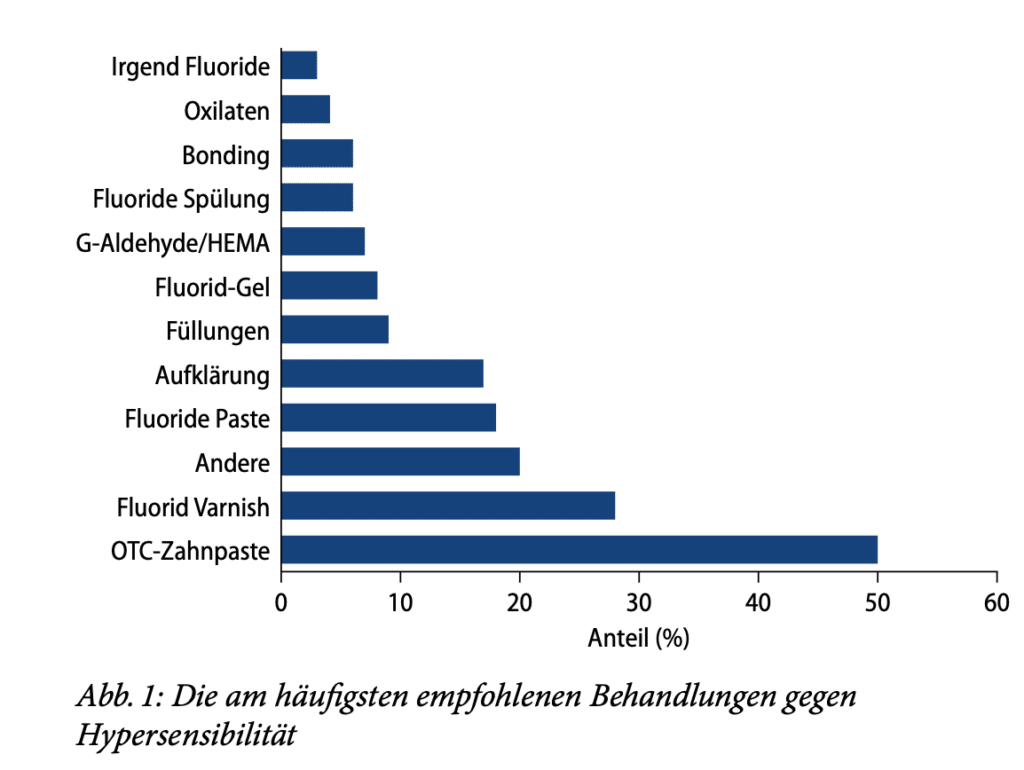
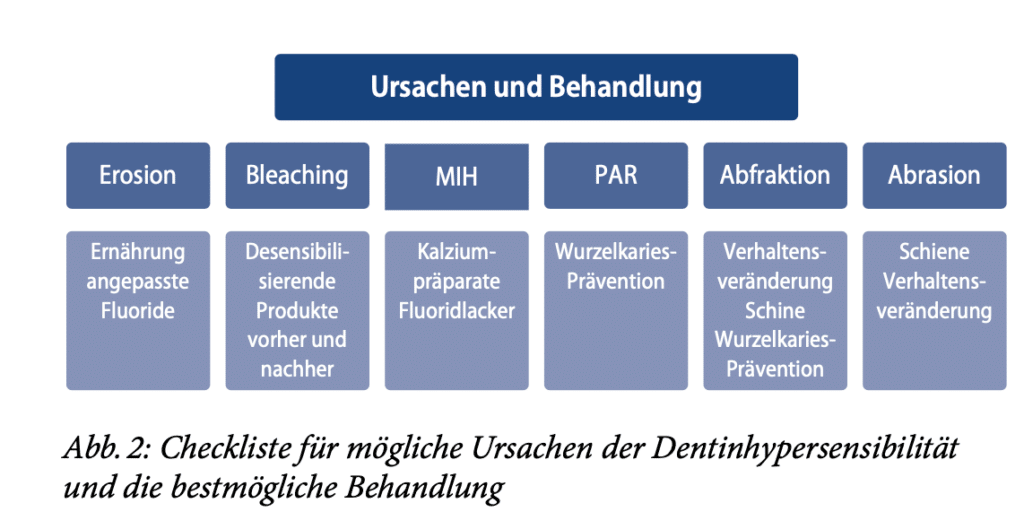
Es gibt verschiedene Ursachen von Dentinhypersensibilität. Die bekanntesten sind Karies, Erosion, Abrasion, Abfraktion, Parodontitis, Molaren-Inzisiven-Hypomineralisation und Bleaching. Diagnose und Behandlung der Dentinhypersensibilität sind aufgrund deren multifaktorieller und gelegentlich multiätiologischer Natur komplex. Eine große Herausforderung in der Behandlung ist die Subjektivität der individuellen Schmerzwahrnehmung. Auch das Vorhandensein von Störfaktoren wie Ernährung, Hygiene, Rauchen und parafunktionellen Gewohnheiten sowie die Gesundheit der Pulpa und des Parodonts können die Diagnostik und Behandlung der Dentinhypersensibilität erschweren [16]. Die therapeutischen Modalitäten können in zwei unterschiedliche Ansätze zur Behandlung offener Dentintubuli unterteilt werden. Bei der ersten Modalität handelt es sich um lokale oder systemische Behandlungen, die darauf abzielen, die eigentlichen Schmerzsymptome zu beruhigen oder zu lindern. Die zweite Modalität ist ein mechanischer Ansatz, bei dem die Tubuli abgedichtet werden sollen. Der mechanische Ansatz kann weiter unterteilt werden nach dem Einsatz rein mechanischer Blockiermittel (Lacke und Versiegelungen) oder solcher Mittel, die die Remineralisierung und/oder das Verstopfen der Tubuli fördern, eine weitere Demineralisierung verhindern oder tatsächlich Mineralien im Tubulus ablagern sollen. Betäubende Mittel können sowohl bei der anfänglichen mechanischen Verstopfung als auch beim langfristigen Remineralisierungsprozess eine Rolle spielen. Die häufigste medikamentöse Behandlung ist die Zugabe von 5 % Kaliumnitrat oder Kaliumcitrat zu Zahnpasta. Beide Substanzen zeigten eine klinische Wirksamkeit, wenngleich die Wirkungen unterschiedlich ausfielen. Kalziumprodukte werden seit Jahrzehnten empfohlen, wobei Analysen von In-vitro-Daten eine Verengung der Tubuli bei Behandlung mit Kalziumhydroxid belegen. Anfang der 1990er-Jahre wurde ein Produkt auf der Basis von amorphem Kalziumphosphat (ACP) in den Handel gebracht. Das Zahnputzmittel enthielt Natriumfluorid, Kalziumsalze und Phosphatsalze [17]. Es ist allgemein anerkannt, dass Speichel mehrere Funktionen bei der Verhinderung der Demineralisierung und sogar bei der Förderung der Remineralisierung hat. Zu diesen Funktionen gehören die Pufferung von Säuren mithilfe von Bikarbonat, Speichelproteinen und Kalziumphosphat sowie die Verdünnung und Beseitigung erosiver Wirkstoffe. Eine Verbesserung der Speichelfunktion könnte also auch ein Behandlungsansatz sein. Die lokale Applikation von Kaliumnitrat vor und nach Bleaching kann laut einer Studie die Hypersensibilität verringern [18]. Die Zahnaufhellung wurde durch die lokale Applikation nicht beeinflusst. Verschiedene Behandlungsmodalitäten werden in der klinischen Routine von Zahnärzten direkt angewendet oder für den Heimgebrauch verschrieben, mit unterschiedlichem Wirksamkeitsgrad. Etwa 50 % der Zahnarztpraxen berichten von einem Mangel an Vertrauen der Patienten in die Behandlung der Dentinhypersensibilität-bedingten Schmerzen. Viele Zahnärzte empfehlen eine Reihe unterschiedlicher Modalitäten für die Behandlung von DH in der Praxis. Einige Zahnärzte empfehlen eine einzelne Behandlungsmethode, andere empfehlen eine Kombination von Behandlungen. Die von den Zahnärzten am häufigsten empfohlene Behandlung ist die Verwendung einer rezeptfreien („over the counter“ [OTC]) desensibilisierenden Kaliumnitrat-Zahnpasta, allein oder in Kombination mit anderen Behandlungen. Dieses Regime wird bei ca. 50 % der Patienten empfohlen, gefolgt von der Anwendung von Fluoridlack (28 %) und einer Behandlung, die als „andere“ kategorisiert wurde, einschließlich desensibilisierender OTC-Streifen bei 21 % der Patienten mit Dentinhypersensibilität. Die Verschreibung von Fluoridzahnpasta wird bei 17 % empfohlen. 8 % der Patienten wird eine restaurative Behandlung nahegelegt. Zusammenfassend kann man sagen, dass desensibilisierende rezeptfreie Kaliumnitrat-Zahnpasta und Fluoridprodukte zurzeit die am häufigsten empfohlenen Produkte zur Behandlung von Dentinhypersensibilität in der Praxis sind (Abb. 1). Beispiele für beliebte Desensibilisierungsmittel in Form von Fluoridlacken sind Provanish (VOCO) und Duraphat (CP GABA). Andere In-Office-Desensibilisatoren sind GLUMA-Produkte (Heraeus Kulzer), Sensodyne MultiCare Zahnpasta (GlaxoSmithKline/Hale-on), Elmex Sensitive Professional (CP GABA), MI Paste (GC)und Bifluorid (VOCO) [19, 20, 21]. Durch eine Metaanalyse konnte ein alternativer Therapieansatz gestärkt werden: Der Einsatz eines Low-power-Lasers in der Therapie von Dentinhypersensibilität führte dazu, dass die von Patienten berichteten durchschnittlichen Schmerzen nach 3-monatiger Nachbeobachtungszeit im Vergleich zu den durchschnittlichen Schmerzen vor der Behandlung mit der Lasertherapie geringer waren. Die Verbesserung der Lasertechnologie hat dazu geführt, dass die Lasertherapie als neue Behandlungsalternative für Dentinhypersensibilität in Erwägung gezogen werden kann [22]. Wichtig bei diesem Therapieansatz sind die vorausgehende Anamnese und Diagnose sowie die Präferenzen der Praxis.